Epidemiologische Grundlagen
Zu wissen, wie und mit welchem Schweregrad sich Krankheitserreger mit pandemischem Potenzial ausbreiten, ist entscheidend um die Früherkennung, Risikobeurteilung und Infektionskontrolle strategisch zu planen.
Krankheitserreger
Krankheitserreger mit pandemischem Potenzial sind Viren, Bakterien und andere Mikroorganismen, die in der Lage sind, sich schnell in einer ungeschützten Bevölkerung weltweit zu verbreiten. Typische Merkmale dieser neuen oder veränderten Erreger sind hohe Übertragbarkeit, geringe oder fehlende Immunität in der Bevölkerung und das Potenzial, eine hohe Anzahl von schweren Erkrankungen oder Todesfällen zu verursachen. Pandemische Krankheitserreger sind häufig zoonotischen Ursprungs, wobei Tiere meist als Reservoir dienen und eine Übertragung auf den Menschen erfolgen kann.
Die Weltgesundheitsorganisation (WHO) veröffentlichte 2024 die Ergebnisse einer Bewertung von 1652 Krankheitserregern hinsichtlich ihres pandemischen Potenzials, basierend auf ihrer Übertragbarkeit, ihrer Virulenz und der Verfügbarkeit medizinischer Gegenmassnahmen. 34 dieser Erreger wurden priorisiert, da sie gut erforscht sind und es Hinweise dafür gibt, dass sie eine gesundheitliche Notlage internationaler Tragweite oder eine Pandemie auslösen könnten. In diese Kategorie von Krankheitserregern fallen vor allem virale Atemwegserreger, insbesondere Influenza- und Coronaviren, die seit Beginn des 20. Jahrhunderts bereits mehrere Pandemien verursacht haben (Tabelle 1). Vor dem Hintergrund dieser Erfahrungen konzentriert sich der Pandemieplan der Schweiz auf respiratorische Viren und berücksichtigt ein breites Spektrum möglicher Szenarien. So sollen die Grundlagen für eine angemessene Pandemievorbereitung und -bewältigung geschaffen und den Herausforderungen durch neue und veränderte Krankheitserreger Rechnung getragen werden.
Influenzaviren
Influenza ist eine akute Infektionskrankheit, verursacht durch Influenzaviren der Familie Orthomyxoviridae. Diese werden aufgrund ihrer antigenen Eigenschaften in die Typen A, B, C und D unterteilt. Beim Menschen haben die Typen A und B die grösste epidemiologische Bedeutung. Es handelt sich dabei um umhüllte RNA-Viren mit acht Genomsegmenten. Sie verfügen über die Oberflächenproteine Hämagglutinin (H) und Neuraminidase (N), die bei der Virusvermehrung und -ausbreitung im Wirt eine wichtige Rolle spielen. Für Influenzaviren vom Typ A gibt es 18 Varianten von Hämagglutinin, die mit H1 bis H18 bezeichnet werden, und 11 Varianten von Neuraminidase, die mit N1 bis N11 bezeichnet werden.
Coronaviren
Coronaviren (Familie Coronaviridae) sind eine Gruppe von RNA-Viren, die sowohl im Menschen als auch in Tieren unterschiedliche Erkrankungen auslösen können. Ihren Namen verdanken sie den keulenförmigen Spike-Proteinen auf ihrer Oberfläche, die als Liganden zum Andocken an spezifische Rezeptoren auf der Zelloberfläche dienen.
Es gibt vier humane Coronaviren (HCoV-229E, HCoV-NL63, HCoV-OC43, HCoV-HKU1), die vorwiegend leichte Erkältungssymptome verursachen. Trotz ihrer weltweiten Verbreitung verlaufen Infektionen bei den meisten Menschen mild oder symptomlos. Schwere Verläufe und Komplikationen treten nur selten auf und betreffen vor allem immungeschwächte Personen oder ältere Menschen. Seit Beginn des 21. Jahrhunderts haben drei neue zoonotische Coronaviren besondere Bedeutung erlangt, da sie zu Ausbrüchen, Epidemien und Pandemien geführt haben:
Zahlreiche Coronaviren zirkulieren in Tierpopulationen, insbesondere bei Fledermäusen, Nagetieren und bestimmten Nutztierarten. Genetische Veränderungen in den Viren können zu einer Anpassung an die Übertragung auf Menschen führen und Infektionen auslösen. Im Fall von SARS-CoV wurde der Larvenroller (Art aus der Familie der Schleichkatzen) als möglicher Zwischenwirt identifiziert, während für MERS-CoV Dromedare eine wichtige Rolle spielen. Auch bei SARS-CoV-2 gehen viele Fachleute davon aus, dass es ursprünglich von Fledermäusen stammt und über einen noch unbekannten Zwischenwirt auf den Menschen überging. Das Risiko, dass weitere zoonotische Coronaviren auf den Menschen überspringen, bleibt bestehen und unterstreicht die Bedeutung des One Health-Ansatzes.
Evolution
Die Evolution respiratorischer Viren wird durch mehrere Mechanismen angetrieben, die ihre genetische Vielfalt erhöhen und damit ihre Eigenschaften beeinflussen können. Bei Influenzaviren spielen zwei Phänomene eine entscheidende Rolle bei der Entstehung neuer Virusvarianten:
- Antigendrift beruht auf kleinen Veränderungen (Punktmutationen) in den Genen der Oberflächenproteine Hämagglutinin (H) und Neuraminidase (N), die die antigenen Eigenschaften des Virus verändern und fortlaufend neue Varianten hervorbringen. Der kontinuierliche Antigendrift ist verantwortlich für die saisonalen Grippewellen, da die Bevölkerung nur teilweise gegen das veränderte Virus immun ist. Folglich müssen die Influenza-Impfstoffe jährlich an die aktuell zirkulierenden Virusstämme angepasst werden.
- Antigenshift entsteht durch den Austausch von Gensegmenten zwischen zwei verschiedenen Subtypen und führt zu einer umfassenderen Veränderung im Genom von Influenzaviren als der Antigendrift. Durch Antigenshift kann ein völlig neuer Subtyp entstehen. Dabei können entweder die Hämagglutinine und Neuraminidase einzeln oder beide gleichzeitig betroffen sein. Antigenshift wurde bisher nur bei Influenza-A-Viren festgestellt. Dieser Prozess ist stark mit dem Auftreten von Pandemien verbunden, da das neu entstandene Virus von der Immunabwehr der Bevölkerung nicht erkannt wird. Dies kann zu einer raschen und weiten Verbreitung führen.
Auch bei Coronaviren können Punktmutationen im Gen des Oberflächenproteins (Spike-Protein) analog zur Antigendrift bei Influenzaviren zu einer allmählichen Abnahme der Antikörpererkennung führen. Zudem kommt es durch Rekombination bei gleichzeitiger Infektion mit unterschiedlichen Coronaviren zur Vermischung von Genomabschnitten. So können Varianten entstehen, die sich hinsichtlich Übertragbarkeit und Virulenz unterscheiden.
Übertragungswege
Der Übertragungsweg eines Krankheitserregers ist ein entscheidender Faktor für die Dynamik und Kontrolle seiner Ausbreitung. Krankheitserreger nutzen verschiedene Mechanismen, um von einem Wirt auf den nächsten zu gelangen. Zur allgemeinen Übersicht zeigt Tabelle 2 Beispiele für die Übertragungswege verschiedener Erreger mit und ohne Pandemiepotenzial. Ein grundlegendes Verständnis dieser Wege ist notwendig, um effektive Präventions- und Kontrollmassnahmen zu entwickeln. Der Hauptübertragungsweg eines bestimmten Krankheitserregers wird in der Regel anhand epidemiologischer Daten ermittelt. Die meisten Erreger können über verschiedene Wege übertragen werden; Präventions- und Kontrollmassnahmen konzentrieren sich jedoch häufig auf den Hauptübertragungsweg.
Aufgrund ihres pandemischen Potenzials und der historischen Erfahrungen erfordern die Übertragungswege respiratorischer Viren besondere Aufmerksamkeit. Die Hauptübertragungswege dieser Krankheitserreger umfassen die aerogene Übertragung (Tröpfchen und Aerosole) sowie den direkten Kontakt über Hände und den indirekten Kontakt über kontaminierte Oberflächen.
Die aerogene Übertragung wurde historisch in zwei Gruppen unterteilt: Als Tröpfchenübertragung wurde die Infektion durch grössere Partikel mit rascher Sedimentation bezeichnet, die sich primär auf das nahe Umfeld (1–2 Meter) einer infizierten Person beschränkt. Als Aerosolübertragung wurde die Infektion durch kleinere Partikel mit längerer Suspensionszeit bezeichnet, die auch über weitere Distanzen, insbesondere innerhalb eines Raums, möglich sind. Diese Dichotomisierung hat sich, auch aufgrund der Erfahrungen aus der Covid-19-Pandemie, als zu stark vereinfacht und physikalisch falsch erwiesen. So handelt es sich bei einer «Tröpfchenübertragung» meist um eine Übertragung durch Tröpfchen (z. B. durch Sprechen und Niesen) und Aerosole, die insbesondere im Nahbereich einer infizierten Person auftreten kann. Bei schlechter Durchlüftung ist auch eine Fernübertragung möglich. Die WHO verwendet in diesem Zusammenhang die vorläufigen englischen Begriffe «spray» (Sprühübertragung) und «inhalation» (Inhalation).
Morbidität und Mortalität
Die Morbidität beschreibt die Häufigkeit oder das Ausmass einer Infektionskrankheit in einer Population oder bestimmten Bevölkerungsgruppe. Die Mortalität hingegen gibt die Häufigkeit der durch den Krankheitserreger verursachten Todesfälle in einer Population oder bestimmten Bevölkerungsgruppe an. Pandemische und potenziell pandemische Krankheitserreger können sich stark in ihrer Morbidität und Mortalität unterscheiden. Während einige Erreger vorwiegend milde Symptome hervorrufen und nur ein sehr kleiner Teil der Bevölkerung schwer erkrankt, besteht bei anderen ein erhebliches Risiko für schwere Verläufe und Todesfälle. Dies gilt insbesondere für Personen mit Vorerkrankungen oder geschwächtem Immunsystem. Auch Faktoren wie Alter, Schwangerschaft und sozioökonomische Bedingungen beeinflussen das Erkrankungs- und Sterberisiko.
Die Auswirkungen auf die öffentliche Gesundheit ergeben sich dabei nicht nur durch die absolute Zahl der Erkrankungen und Todesfälle, sondern auch durch die Ausbreitungsdynamik. Pandemische Erreger können sehr schnell die Kapazitätsgrenzen von Gesundheitseinrichtungen erreichen, insbesondere wenn die intensivmedizinische Versorgung nur begrenzt verfügbar ist. Für die strategische Planung der Pandemievorbereitung und -bewältigung ist es daher unerlässlich, sowohl die epidemiologischen Eigenschaften dieser Erreger als auch die klinischen Charakteristika der von ihnen verursachten Erkrankung zu berücksichtigen. Auf Grundlage dieser Daten können fortlaufend Risikobeurteilungen erstellt und Szenarien zur möglichen Belastung des Gesundheitssystems abgeleitet werden (Tabelle 3).
Ein wichtiger Indikator für die Morbidität ist die Befallsrate. Diese gibt den Anteil einer Population oder bestimmten Bevölkerungsgruppe an, der mit einem Erreger infiziert wird. Eine Aufteilung in asymptomatische, symptomatische und diagnostizierte Fälle ermöglicht Rückschlüsse auf unerkannte Infektionsketten und das Meldesystem. Zur Einschätzung des klinischen Schweregrads der Erkrankung werden verschiedene weitere Indikatoren herangezogen. Die Hospitalisierungsrate misst den Anteil der infizierten Personen, die aufgrund ihrer Erkrankung hospitalisiert werden müssen. Die Intensivpflegerate beschreibt jene Personen, die eine intensivmedizinische Versorgung benötigen. Auch Langzeitfolgen, beispielsweise Myalgische Enzephalomyelitis/Chronisches Fatigue-Syndrom (ME/CFS), gehören in diese Kategorie.
Die wichtigsten Mortalitätsindikatoren sind die Fallsterblichkeit und die Infektionssterblichkeit. Erstere bezieht sich auf den Anteil der diagnostizierten Fälle, die an der Erkrankung sterben, während letztere alle Infizierten, also auch die unentdeckten Infektionen, umfasst. Schliesslich wird mit der Übersterblichkeit jene über das zu erwartende Mass hinausgehende Mortalität bezeichnet, die ein Krankheitserreger verursacht.
Ausbreitungsdynamik
Krankheitserreger können in einer Population unterschiedliche Verbreitungsformen annehmen: Ausbrüche sind auf zeitlich und örtlich klar begrenzte Häufungen von Infektionen beschränkt. Bei einer Epidemie hingegen handelt es sich um eine kontinuierliche Zunahme eines Erregers (steigende Inzidenz) in einer grösseren Region oder Bevölkerung über einen längeren Zeitraum. Im Gegensatz dazu ist eine Endemie dadurch gekennzeichnet, dass ein Erreger mit stabiler Inzidenz auftritt, ohne dass es zu einer ungewöhnlich hohen Zahl an Erkrankungen kommt. Greift eine Epidemie über Kontinente hinweg auf einen grossen Teil der Weltbevölkerung über, spricht man von einer Pandemie.
Die Übertragung von Krankheitserregern kann zu einem exponentiellen Wachstum von Infektionen führen, insbesondere wenn viele Menschen empfänglich sind und keine oder nur unzureichende Infektionskontrolle erfolgt. Charakteristisch hierfür sind epidemische Wellen, in denen die Inzidenz zunächst ansteigt, einen Höhepunkt erreicht und anschliessend wieder zurückgeht. Bei viralen Atemwegserregern kommt es aufgrund der Übertragungseigenschaften häufig zu einer Saisonalität, die dazu führt, dass die Erkrankungen während den Wintermonaten zunehmen. Zudem können mehrere Infektionswellen aufeinander folgen, insbesondere wenn die Immunität in der Bevölkerung ungenügend ist oder neue Virusvarianten entstehen.
Zwei zentrale epidemiologische Konzepte sind entscheidend, um diese Ausbreitungsdynamik zu verstehen: die Reproduktionszahl und das Phänomen des Superspreading.
Reproduktionszahl
Die Basis-Reproduktionszahl (R0) beschreibt, wie viele Personen eine infizierte Person im Durchschnitt ansteckt, wenn weder Immunität in der Bevölkerung besteht noch Massnahmen zur Infektionskontrolle ergriffen werden. Dieser Wert ist daher ein Mass für das maximale Ausbreitungspotenzial eines Krankheitserregers in einer vollständig empfänglichen Population. Verschiedene Faktoren beeinflussen R0, darunter die Kontagiosität (Ansteckungskraft) des Krankheitserregers, die Dauer der Kontagiosität, die Anzahl der Kontakte zwischen Personen und die Durchmischung der Bevölkerung. Im Gegensatz dazu bezieht sich der R-Wert, auch als effektive Reproduktionszahl (Re oder Reff) bezeichnet, auf eine Situation, in der bereits eine gewisse Immunität vorhanden ist und/oder Kontrollmassnahmen umgesetzt werden. Der R-Wert verändert sich über die Zeit und gibt somit Aufschluss über den aktuellen Verlauf einer Epidemie:
- wenn R > 1, kann sich der Krankheitserreger in der Population ausbreiten und die Anzahl der neuen Infektionen innerhalb eines bestimmten Zeitraums nimmt zu;
- wenn R = 1, dann bleibt die Anzahl der neuen Infektionen konstant;
- wenn R < 1, nimmt die Anzahl der neuen Infektionen ab.
Je höher der R-Wert ist, desto schwieriger lässt sich die Ausbreitung eines Krankheitserregers kontrollieren. Um zu Beginn einer Epidemie eine Eindämmung zu erreichen, also den R-Wert unter die kritische Schwelle von 1 zu senken, müssen 1 - 1/R₀ der Ansteckungen verhindert werden. Bei einem Erreger mit R₀ = 2,5, wie zu Beginn der Covid-19-Pandemie im Jahr 2020, entspricht dies mindestens 60 % der Übertragungen. Wird der R-Wert durch Kontrollmassnahmen zwar verringert, bleibt jedoch über 1, spricht man von Abschwächung. Das bedeutet, dass die Ausbreitung einer Infektionswelle verlangsamt wird. Dadurch sinkt die maximale Anzahl gleichzeitig infizierter und zu versorgender Personen und eine übermässige Belastung oder Überlastung des Gesundheitssystems kann vermieden werden.
Im Pandemiefall sind sowohl R₀ als auch der R-Wert entscheidende Indikatoren, um das Ausbreitungspotenzial abzuschätzen, eine laufende Risiko- und Lagebeurteilung vorzunehmen und eine geeignete Strategie zur Eindämmung oder Abschwächung (Infektionskontrolle) festzulegen.
Superspreading
Superspreading beschreibt das Phänomen, bei dem einzelne Infizierte überdurchschnittlich viele Sekundärfälle verursachen, während die Mehrheit nur wenige oder niemanden ansteckt. Dabei können sowohl biologische Faktoren des Erregers und des Wirts als auch ein spezifisches Verhalten eine Rolle spielen. Ein sogenannter «Superspreading-Event» liegt vor, wenn eine infizierte Person mehr Personen ansteckt, als nach der 99. Perzentile einer Poisson-Verteilung mit dem Erwartungswert R₀ zu erwarten wäre. Bei einem Krankheitserreger mit R₀ = 2,5 spricht man demnach von Superspreading, wenn mehr als sieben weitere Personen infiziert werden.
Die ungleiche Verteilung der Sekundärfälle wird durch den Dispersionsfaktor k beschrieben. Ein niedriger Wert (k < 1) deutet auf eine hohe Variabilität bei der Anzahl der Sekundärfälle hin, sodass eine Minderheit (10–20 %) der infizierten Personen die Mehrheit (80 %) der Ansteckungen verursacht. Beispiele für Erreger, bei denen es häufig zu Superspreading kommt, sind das Ebolavirus, SARS-CoV und MERS-CoV. Dieses ungleichmässige Verteilungsmuster hat erhebliche Auswirkungen auf die strategische Planung und Umsetzung von Massnahmen zur Infektionskontrolle: Kontaktmanagement (Contact Tracing) ist besonders effektiv, wenn es gezielt auf Superspreading-Events ausgerichtet wird.
Pandemiephasen
Die Einteilung einer Pandemie in verschiedene Entwicklungsphasen ist ein wichtiges Instrument für die strategische Planung und operative Umsetzung von Massnahmen. Die Ziele der Pandemievorbereitung und -bewältigung richten sich dabei nach den jeweiligen Entwicklungsphasen. Eine klare und objektivierte Beschreibung dieser Phasen unterstützt die frühzeitige Anpassung von Massnahmen an die aktuelle Lage und erleichtert die Koordination zwischen den zuständigen Stellen.
Der nationale Pandemieplan unterscheidet vier Phasen, die sich an der epidemiologischen Lage in der Schweiz im Zusammenhang mit einem neuen Krankheitserreger orientieren:
Die Dauer der einzelnen Phasen kann stark variieren; Übergänge, etwa von der interpandemischen zur pandemischen Phase, können zuweilen sehr rasch erfolgen. Zudem ist zu beachten, dass die «Pandemiephasen», die «Pandemiestufen» der WHO und das «Lagemodell» gemäss EpG einen unterschiedlichen Fokus haben: Während die Pandemiephasen die epidemiologische Lage auf nationaler Ebene widerspiegeln, beziehen sich die Pandemiestufen der WHO auf globale Entwicklungen. Das Lagemodell bezieht sich auf das potenzielle Ausmass der Krise in der Schweiz.
Risikobeurteilung und Szenarien
Risikobeurteilungen und Szenarien sind unerlässlich, um mögliche Auswirkungen pandemischer Krankheitserreger einzuschätzen und gezielte Massnahmen zur Vorbereitung und Bewältigung einer Pandemie zu entwickeln. Während die Risikobeurteilung eine systematische Analyse aktueller Bedrohungen ermöglicht und somit der Früherkennung dient, sollen Szenarien mögliche Entwicklungen aufzeigen und langfristige Planungen unterstützen. Dies ist besonders relevant für virale Atemwegserreger wie Influenza- und Coronaviren, die sich rasch global ausbreiten können und für die ausreichend Erfahrungswerte mit unterschiedlichen Schweregraden vorliegen.
Für die Durchführung von Risikobeurteilungen und die Entwicklung von Szenarien stehen die folgenden wissenschaftlichen Methoden zur Verfügung:
- Operational tool on rapid risk assessment methodology: Dieses Instrument des European Centre for Disease Prevention and Control (ECDC) erlaubt eine schnelle, strukturierte und reproduzierbare Risikobeurteilung für neue Krankheitserreger. Das Risiko wird dabei anhand von sieben Fragen als Kombination der Wahrscheinlichkeit des Auftretens und der Ausbreitung des Krankheitserregers sowie den potenziellen Auswirkungen auf die öffentliche Gesundheit anhand einer Risikomatrix bestimmt. Das Instrument wird insbesondere in der interpandemischen und der initialen Phase einer Pandemie eingesetzt.
- Pandemic Severity Assessment Framework (PSAF): Dieses Instrument des US-amerikanischen Centers for Disease Control and Prevention (CDC) dient dazu, sowohl die Übertragbarkeit als auch den klinischen Schweregrad einer Pandemie zu bewerten und diese zu einer Gesamteinschätzung der potenziellen Auswirkungen zusammenzuführen. Die Übertragbarkeit kann dabei anhand von R0 oder der erwarteten Befallsrate ermittelt werden, während der klinische Schweregrad durch Kennzahlen wie die Hospitalisierungsrate oder die Infektionssterblichkeit bestimmt wird. Das Instrument wird primär während der initialen und pandemischen Phase eingesetzt, kann jedoch auch in der interpandemischen Phase dazu dienen, Szenarien zu entwickeln.
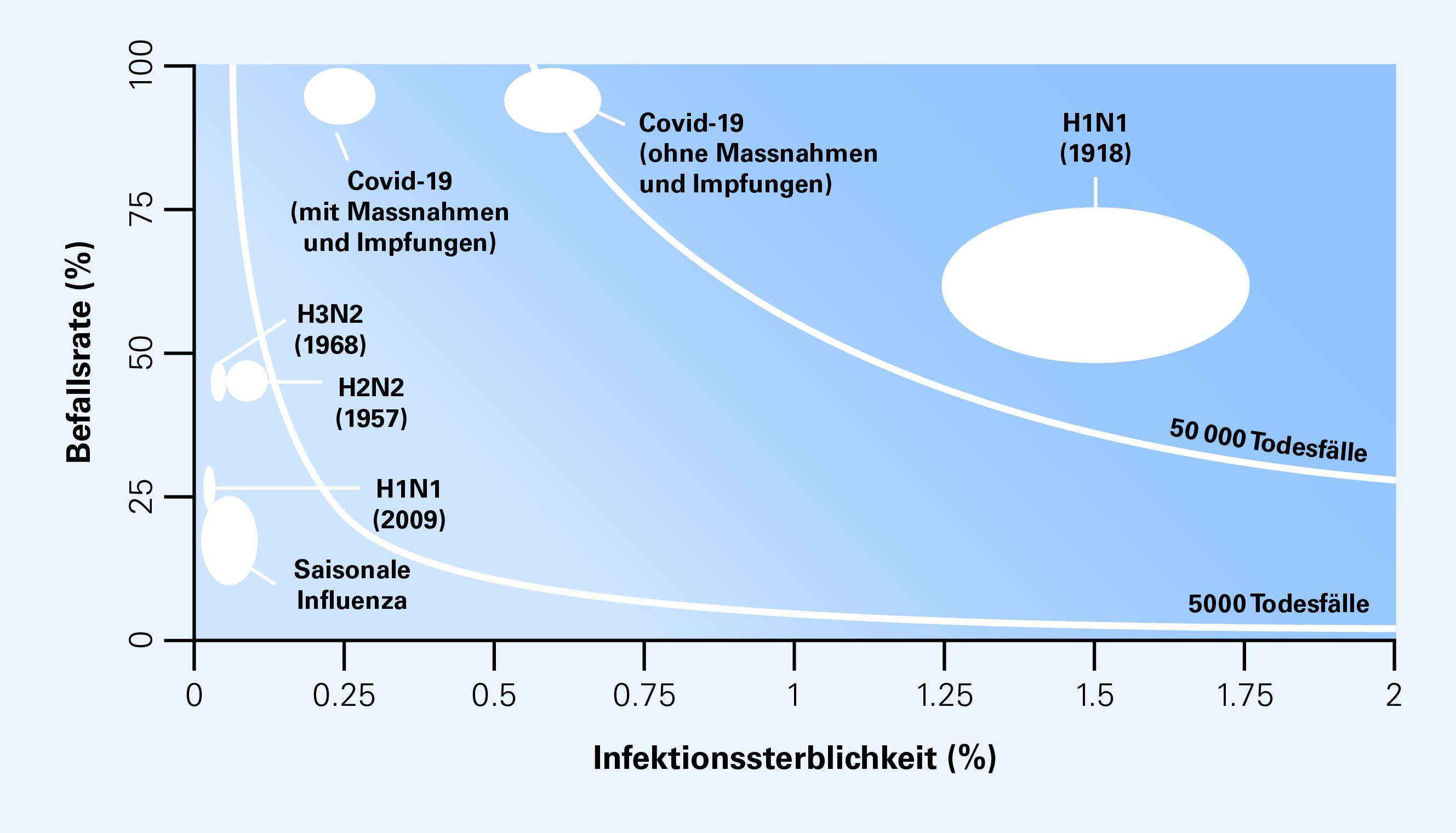
Der Schweregrad einer Pandemie kann anhand der Anzahl Todesfälle, die sich aus einer bestimmten Befallsrate und Infektionssterblichkeit ergeben, veranschaulicht werden (Abbildung 1). Dies ermöglicht den Vergleich verschiedener Pandemieszenarien mit den Auswirkungen vergangener Pandemien oder der saisonalen Influenza. Die historischen Beispiele, die von moderaten Ereignissen wie der pandemischen H1N1-Influenza im Jahr 2009 bis hin zu extremen Ereignissen wie der Influenza-Pandemie von 1918 reichen, verdeutlichen die enorme Bandbreite möglicher Szenarien. Bezogen auf die Bevölkerungsgrösse der Schweiz (9 Millionen Ende 2024) lässt sich der Schweregrad einer Pandemie, die durch einen viralen Atemwegserreger verursacht wird, grob in drei Szenarien unterteilen:
Der Zeithorizont, über den sich die pandemische Phase erstreckt, die Anzahl der Infektionswellen sowie die Zahl der gleichzeitig infizierten und zu versorgenden Personen müssen in der strategischen Planung ebenfalls berücksichtigt werden. Darüber hinaus sollte der Schweregrad einer Pandemie nicht nur anhand der zu erwartenden Anzahl Todesfälle bewertet werden, sondern auch durch weitere Parameter wie die Anzahl schwerer Erkrankungen in unterschiedlichen Alters- und Bevölkerungsgruppen oder mögliche Langzeitfolgen einer Infektion.
Unsicherheiten bestehen allerdings sowohl bei Risikobeurteilungen wie auch bei der Erstellung von Szenarien. Denn detaillierte Informationen zur Übertragbarkeit und zum klinischen Schweregrad sind nicht immer frühzeitig verfügbar oder lassen sich nicht präzise genug bestimmen. Dennoch sind sie unverzichtbare Werkzeuge, um mögliche Entwicklungen abzuschätzen und geeignete Massnahmen vorzubereiten. Eine regelmässige Anpassung an neue wissenschaftliche Erkenntnisse ist dabei zentral.

