Bases épidémiologiques
Pour planifier de façon stratégique la détection précoce, l’évaluation des risques et le contrôle des infections, il est essentiel de connaître la manière dont les agents pathogènes au potentiel pandémique se propagent ainsi que leur degré de gravité.
Agents pathogènes
Les agents pathogènes au potentiel pandémique sont des virus, des bactéries et d’autres micro-organismes pouvant se propager rapidement à l’échelle mondiale au sein d’une population vulnérable. En général, ces agents nouveaux ou modifiés se caractérisent par une transmissibilité élevée, par une immunité moindre ou nulle au sein de la population et par leur capacité à causer, potentiellement, un grand nombre de cas graves ou de décès. Les agents pathogènes pandémiques ont souvent une origine zoonotique, les animaux faisant en général office de réservoir, avec une possibilité de transmission à l’être humain.
En 2024, l’Organisation mondiale de la santé (OMS) a publié les résultats d’une évaluation du potentiel pandémique de 1652 agents pathogènes, établie sur la base de leur transmissibilité, de leur virulence et de l’existence de mesures médicales de riposte. Trente-quatre de ces agents ont été définis comme prioritaires, car ils sont bien étudiés et certains éléments indiquent qu’ils pourraient causer une urgence de santé publique de portée internationale ou une pandémie. Dans cette catégorie d’agents pathogènes, on trouve surtout des virus s’attaquant aux voies respiratoires, en particulier des virus de la grippe et des coronavirus, qui ont déjà été à l’origine de plusieurs pandémies depuis le début du XXe siècle (tableau 1). Au vu de ces expériences, le Plan suisse de pandémie se concentre sur les virus respiratoires et tient compte d’un large éventail de scénarios possibles. Cette approche permet, d’une part, de formuler les principes d’une préparation aux pandémies et d’une gestion des pandémies qui soient appropriées et, d’autre part, de prendre en compte les défis posés par des agents pathogènes nouveaux ou modifiés.
Virus de la grippe
La grippe est une maladie infectieuse aiguë causée par des virus grippaux de la famille des Orthomyxoviridae. Ces virus sont subdivisés en types (A, B, C et D) selon leurs caractéristiques antigéniques. Chez l’être humain, les grippes de type A et B sont les plus importantes sur le plan épidémiologique. Ils sont des virus enveloppés au génome composé de huit segments d’ARN. Ils présentent à leur surface deux protéines, l’hémagglutinine (H) et la neuraminidase (N), qui jouent un rôle essentiel dans la réplication et la diffusion du virus dans l’hôte. Pour les virus grippaux de type A, il existe 18 variantes d'hémagglutinine, notés H1 à H18, et 11 variantes de neuraminidase, notés N1 à N11.»
Coronavirus
Les coronavirus (famille des Coronaviridae) sont un groupe de virus à ARN susceptibles de déclencher diverses maladies chez l’être humain comme chez l’animal. Ils doivent leur nom aux protéines en forme de clou, appelées protéines spike, qui sont présentes à leur surface et qui agissent comme ligand pour se fixer sur des récepteurs spécifiques à la surface des cellules.
Il existe quatre coronavirus humains (HCoV-229E, HCoV-NL63, HCoV-OC43, HCoV-HKU1), qui provoquent essentiellement des symptômes de refroidissement bénins. Bien qu’ils soient présents dans le monde entier, les infections qu’ils provoquent restent légères ou asymptomatiques dans la plupart des cas. Les évolutions graves et les complications sont rares et touchent surtout des personnes immunodéprimées ou âgées. Depuis le début du XXIe siècle, trois nouveaux coronavirus zoonotiques ont pris une importance particulière car ils ont provoqué des flambées, des épidémies et des pandémies :
De nombreux coronavirus circulent dans des populations animales, en particulier chez les chauves-souris, les rongeurs et certaines espèces d’animaux de rente. Suite à des mutations génétiques, ces virus peuvent devenir transmissibles à l’être humain et provoquer des infections. Dans le cas du SARS-CoV, la civette palmée (une espèce de la famille des Viverridés) a été identifiée comme un hôte intermédiaire possible tandis que, dans le cas du MERS-CoV, c’est le dromadaire qui est en cause. En ce qui concerne le SARS-CoV-2, beaucoup de spécialistes pensent qu’il provient à l’origine de chauves-souris et qu’il a été transmis à l’être humain par l’intermédiaire d’un hôte encore non identifié. Il existe toujours un risque que d’autres coronavirus zoonotiques passent la barrière des espèces pour se transmettre à l’être humain, ce qui souligne l’importance de l’approche One Health (« Une seule santé »).
Évolution
Les virus respiratoires évoluent sous l’impulsion de plusieurs mécanismes qui peuvent augmenter leur diversité génétique et ainsi agir sur leurs propriétés. Dans le cas des virus de la grippe, deux de ces mécanismes jouent un rôle déterminant dans l’apparition de nouveaux variants :
- La dérive antigénique (drift) repose sur des modifications localisées (ponctuelles) dans les gènes des protéines de surface hémagglutinine (H) et neuraminidase (N) qui entraînent la modification des propriétés antigéniques du virus et l’apparition permanente de nouveaux variants. La dérive antigénique continue est responsable des vagues de grippe saisonnière puisque la population n’est immunisée que partiellement contre les variants. La dérive antigénique oblige à adapter chaque année la composition des vaccins antigrippaux aux souches virales en circulation.
- Le saut antigénique (shift) est un échange de segments de gènes entre deux sous-types de virus différents. Il provoque dans le génome des virus grippaux un changement de plus grande ampleur que la dérive antigénique : il a la capacité de générer un sous-type de virus entièrement nouveau. Il peut affecter l’hémagglutinine seule, la neuraminidase seule ou les deux en même temps. À ce jour, le mécanisme du saut antigénique n’a été décrit que sur des virus de type A. Ce processus est fortement corrélé à l’apparition de pandémies car le nouveau virus n’est pas reconnu par les défenses immunitaires en place dans la population, ce qui lui permet de se propager rapidement et largement.
Les coronavirus peuvent eux aussi subir des mutations ponctuelles dans le génome de leur protéine de surface (protéine spike) qui, comme dans la dérive antigénique chez les virus grippaux, affaiblissent progressivement la capacité de détection des anticorps. En outre, lorsque des coronavirus différents infectent une même personne, il se produit un brassage génétique par recombinaison pouvant donner naissance à des variants dont la transmissibilité et la virulence varient.
Voies de transmission
La voie de transmission d’un agent pathogène est la clé de la dynamique et du contrôle de sa propagation. Les agents pathogènes emploient différents mécanismes pour passer d’un hôte à un autre. Le tableau 2 propose un aperçu général des voies de transmission possibles en prenant l’exemple de différents pathogènes, avec ou sans potentiel pandémique. Il est indispensable de bien comprendre les voies de transmission pour pouvoir concevoir des mesures de prévention et de contrôle efficaces. La principale voie de transmission d’un agent pathogène est généralement identifiée en analysant les données épidémiologiques. Même si la plupart des pathogènes peuvent se transmettre par plusieurs voies, les mesures de prévention et de contrôle se concentrent souvent sur la principale.
Les voies de transmission des virus respiratoires requièrent une attention particulière en raison de leur potentiel pandémique et des expériences du passé. La voie aérogène (gouttelettes et aérosols), le contact direct (mains) et le contact indirect (surfaces contaminées) constituent les voies de transmission principales.
Historiquement, on a distingué deux types de transmission par voie aérogène : la transmission par gouttelettes, qui désigne l’infection par des particules de grande taille à sédimentation rapide se produisant essentiellement à proximité d’une personne infectée (1 à 2 mètres), et la transmission par aérosols, qui désigne l’infection par des particules de plus petite taille restant plus longtemps en suspension et pouvant donc se transmettre à des distances plus importantes, en particulier dans une pièce. Mais l’expérience du COVID-19 a montré que cette dichotomie était non seulement simpliste mais aussi fausse du point de vue de la physique. Ainsi, ce que l’on appelle une transmission par gouttelettes implique généralement des gouttelettes (expulsées lorsqu’on parle ou éternue) et des aérosols, et elle peut se produire en particulier à proximité d’une personne infectée. Mais si l’on est dans une pièce mal aérée, la transmission peut aussi se produire à plus grande distance. Dans ce contexte, l’OMS emploie provisoirement les termes spray (pulvérisation) et inhalation (inhalation).
Morbidité et mortalité
La morbidité mesure la fréquence ou l’ampleur d’une maladie infectieuse au sein d’une population ou de groupes déterminés d’une population alors que la mortalité mesure la fréquence des décès causés par le pathogène au sein d’une population ou de groupes déterminés d’une population. Les pathogènes pandémiques ou à potentiel pandémique peuvent avoir des charges de morbidité et de mortalité très différentes. Certains provoquent des symptômes essentiellement bénins et des maladies graves seulement dans une très petite partie de la population tandis que d’autres présentent un risque très important d’évolutions graves et de décès. Cela concerne en particulier les personnes qui sont déjà malades ou qui ont un système immunitaire affaibli, mais des facteurs comme l’âge, une grossesse ou la situation socio-économique influent aussi sur le risque de maladie et de décès.
Les répercussions sur la santé publique résultent non seulement du nombre absolu d’infections et de décès, mais aussi de la dynamique de propagation du pathogène. Les pathogènes pandémiques peuvent très rapidement entraîner une congestion des institutions de santé, en particulier lorsque les capacités de prise en charge en soins intensifs sont limitées. Il est donc indispensable pour la planification stratégique, pour la préparation à une pandémie et pour sa gestion de tenir compte à la fois des caractéristiques épidémiologiques des pathogènes et des caractéristiques cliniques des maladies qu’ils provoquent. Ces données permettent d’évaluer les risques en continu et d’en déduire des scénarios indiquant la charge que le système de santé peut supporter (tableau 3).
Un indicateur important de morbidité est le taux d’attaque, qui indique la proportion de la population ou de groupes déterminés de la population infectée par un agent pathogène. La ventilation des chiffres entre cas asymptomatiques, cas symptomatiques et cas diagnostiqués donne des indications sur des chaînes de transmission restées indétectées et sur le système de déclaration. Pour évaluer la gravité clinique de la maladie, on fait appel à plusieurs autres indicateurs. Le taux d’hospitalisation mesure la proportion de personnes infectées qui doivent être hospitalisées en raison de la maladie contractée. Le taux de soins intensifs établit la proportion de personnes qui ont besoin de soins intensifs. Les conséquences à long terme, comme l’encéphalomyélite myalgique (également appelée syndrome de fatigue chronique, SFC), rentrent aussi dans cette catégorie.
Les principaux indicateurs de mortalité sont le taux de létalité apparent et le taux de létalité réel. Le premier indique la proportion de personnes diagnostiquées qui décèdent de la maladie tandis que le second comprend toutes les personnes infectées, y compris les infections non détectées. Enfin, la surmortalité indique le nombre de décès causés par un pathogène supérieur à la valeur attendue.
Dynamique de propagation
Les agents pathogènes peuvent se propager de différentes manières dans une population. Une flambée est une accumulation de cas clairement circonscrite dans le temps et dans l’espace. Une épidémie, au contraire, est une augmentation continue des infections (incidence croissante) dans une région ou une population de grande taille et pendant une période prolongée. Une endémie se caractérise par la stabilité de l’incidence du pathogène, sans que celui-ci provoque un nombre inhabituellement élevé de cas de maladie. Lorsqu’une épidémie se répand d’un continent à un autre jusqu’à affecter une grande partie de la population mondiale, on parle de pandémie.
La transmission de pathogènes peut entraîner une croissance exponentielle des infections, en particulier lorsqu’un grand nombre de personnes sont susceptibles et que les infections ne sont pas contrôlées ou seulement de manière insuffisante. Un exemple caractéristique de ce phénomène est la vague épidémique, lors de laquelle l’incidence commence par augmenter puis atteint un pic avant de redescendre. En raison de leurs propriétés de transmission, les pathogènes respiratoires d’origine virale présentent souvent une saisonnalité, avec un accroissement des cas de maladie pendant les mois d’hiver. En outre, plusieurs vagues d’infection peuvent se suivre, en particulier si l’immunité dans la population est insuffisante ou si de nouveaux variants du virus apparaissent.
Deux notions épidémiologiques cruciales sont déterminantes pour comprendre cette dynamique de propagation : le taux de reproduction et le phénomène de la super-propagation (superspreading).
Taux de reproduction
Le taux de reproduction de base (R0) indique le nombre moyen de personnes contaminées par une personne infectée lorsqu’il n’y a pas encore d’immunité dans la population ni de mesures visant à contrôler les infections. Ce chiffre mesure donc le potentiel de propagation maximal d’un agent pathogène dans une population entièrement susceptible d’être infectée. Des facteurs variés influent sur le R0, notamment la contagiosité du pathogène, la durée de la contagiosité, le nombre de contacts interpersonnels et le brassage de la population. A contrario, la valeur de R, aussi appelée taux de reproduction effectif (Re ou Reff), désigne une situation dans laquelle il y a déjà une certaine immunité et/ou des mesures de contrôle sont mises en œuvre. La valeur de R varie au fil du temps, reflétant l’évolution de la pandémie :
- si R > 1, le pathogène peut se répandre dans la population et le nombre de nouvelles infections durant une période déterminée augmente ;
- si R = 1, le nombre de nouvelles infections reste constant ;
- si R < 1, le nombre de nouvelles infections diminue.
Plus la valeur de R est élevée, plus il est difficile de contrôler la propagation d’un agent pathogène. Pour endiguer une épidémie à ses débuts, c’est-à-dire pour ramener la valeur de R sous le seuil critique de 1, il faut empêcher 1 - 1/R₀ des infections. Pour un pathogène ayant un R₀ de 2,5, comme au début de la pandémie de COVID-19 en 2020, cela correspond à 60 % des contaminations au moins. Si la valeur de R diminue grâce aux mesures de contrôle mais reste supérieure à 1, on parle d’atténuation. Cela signifie que la propagation de la vague d’infections est ralentie. Le nombre maximal de personnes infectées à prendre en charge en même temps diminue, ce qui permet d’éviter une congestion ou une surcharge du système de santé.
En cas de pandémie, le taux de reproduction de base comme le taux de reproduction effectif sont des indicateurs essentiels pour apprécier le potentiel de propagation du pathogène, évaluer en permanence les risques et la situation et définir une stratégie appropriée pour endiguer ou atténuer la pandémie (contrôle des infections).
Super-propagation (superspreading)
Le phénomène de la super-propagation se caractérise par le nombre très élevé de cas secondaires que certaines personnes infectées peuvent provoquer alors que, de manière générale, la contamination interpersonnelle est faible, voire nulle. Ce phénomène peut s’expliquer par des spécificités biologiques de l’agent pathogène et de son hôte ou par des comportements particuliers. Un événement est dit super-propagateur lorsqu’une personne infectée contamine davantage de personnes que ce qui serait attendu selon le 99e centile d'une distribution de Poisson avec la valeur escomptée R₀. Pour un pathogène dont le R₀ est égal à 2,5, on parle d’événement super-propagateur lorsqu’une seule personne en infecte plus de 7 autres.
L’inégalité de la distribution des cas secondaires est décrite par le coefficient de dispersion k. Une valeur basse (k < 1) indique une forte variabilité dans le nombre de cas secondaires. Cela signifie qu’une minorité de personnes infectées (10 à 20 %) est à l’origine de la majorité des contaminations (80 %). Les événements super-propagateurs sont fréquents dans le cas de pathogènes comme le virus Ebola, le SARS-CoV et le MERS-CoV. Cette dispersion a des répercussions considérables sur la planification stratégique et la mise en œuvre de mesures visant à contrôler l’infection. La gestion des contacts (contact tracing) est particulièrement efficace lorsqu’elle cible les événements super-propagateurs.
Phases de la pandémie
Le découpage d’une pandémie en plusieurs stades d’évolution (phases) est un outil important pour la planification stratégique et la mise en œuvre opérationnelle des mesures. Les objectifs de la préparation à une pandémie et de sa gestion sont différents selon les stades. Il est utile d’avoir une description claire et objectivée des phases de la pandémie pour adapter rapidement les mesures à la situation réelle et faciliter la coordination entre les services compétents.
Le Plan national de pandémie distingue quatre phases basées sur la situation épidémiologique qui prévaut en Suisse en lien avec un nouvel agent pathogène :
Les différentes phases peuvent avoir des durées très variables. Il arrive que les transitions, par exemple entre une phase interpandémique et une phase pandémique, soient très rapides. En outre, il est important de noter que les phases de pandémie décrites ici, la classification de la gravité des pandémies par l’OMS et les situations définies dans la LEp (modèle à trois niveaux) ont des approches différentes : les phases de pandémie du plan national reflètent la situation épidémiologique en Suisse tandis que la classification de l’OMS se rapporte aux évolutions à l’échelle planétaire. Quant aux situations définies dans la LEp, elles se réfèrent à l’ampleur potentielle de la crise en Suisse.
Évaluation des risques et scénarios
Il est indispensable d’évaluer les risques et d’élaborer des scénarios pour estimer l’impact potentiel d’un agent pathogène pandémique et pour concevoir des mesures ciblées en vue de se préparer à une pandémie et de la gérer. L’évaluation des risques permet une analyse systématique des menaces en cours et donc la mise en œuvre d’une détection précoce tandis que les scénarios montrent des évolutions possibles et appuient ainsi les planifications à long terme. Cette démarche est particulièrement pertinente pour les pathogènes respiratoires d’origine virale, comme les virus grippaux et les coronavirus, qui peuvent se répandre rapidement dans le monde et pour lesquels nous disposons de quantités suffisantes de chiffres empiriques se rapportant à des degrés de gravité variés.
Deux méthodes scientifiques sont disponibles pour évaluer les risques et développer des scénarios :
- Operational tool on rapid risk assessment methodology : cet outil du Centre européen de prévention et de contrôle des maladies (ECDC) permet une évaluation rapide, structurée et reproductible des risques posés par de nouveaux agents pathogènes. Il évalue les risques en combinant les probabilités d’apparition et de propagation du pathogène dans une matrice ainsi que les conséquences potentielles pour la santé publique déterminées à l’aide de sept questions. Cet outil est utilisé avant tout en phase interpandémique et lors de la phase initiale d’une pandémie.
- Pandemic Severity Assessment Framework (PSAF) : cet outil du Centre américain de prévention et de contrôle des maladies (Center for Disease Control and Prevention, CDC) permet d’évaluer la transmissibilité d’un agent pathogène et le degré de gravité clinique d’une pandémie puis de combiner ces deux aspects pour évaluer globalement les conséquences potentielles. La transmissibilité peut être déterminée sur la base du R0 et des taux d’attaque attendus tandis que le degré de gravité clinique est déduit d’indicateurs tels que le taux d’hospitalisation ou le taux de létalité réel. Cet outil est employé avant tout durant la phase initiale et la phase pandémique, même s’il peut être utile pour élaborer des scénarios en phase interpandémique.
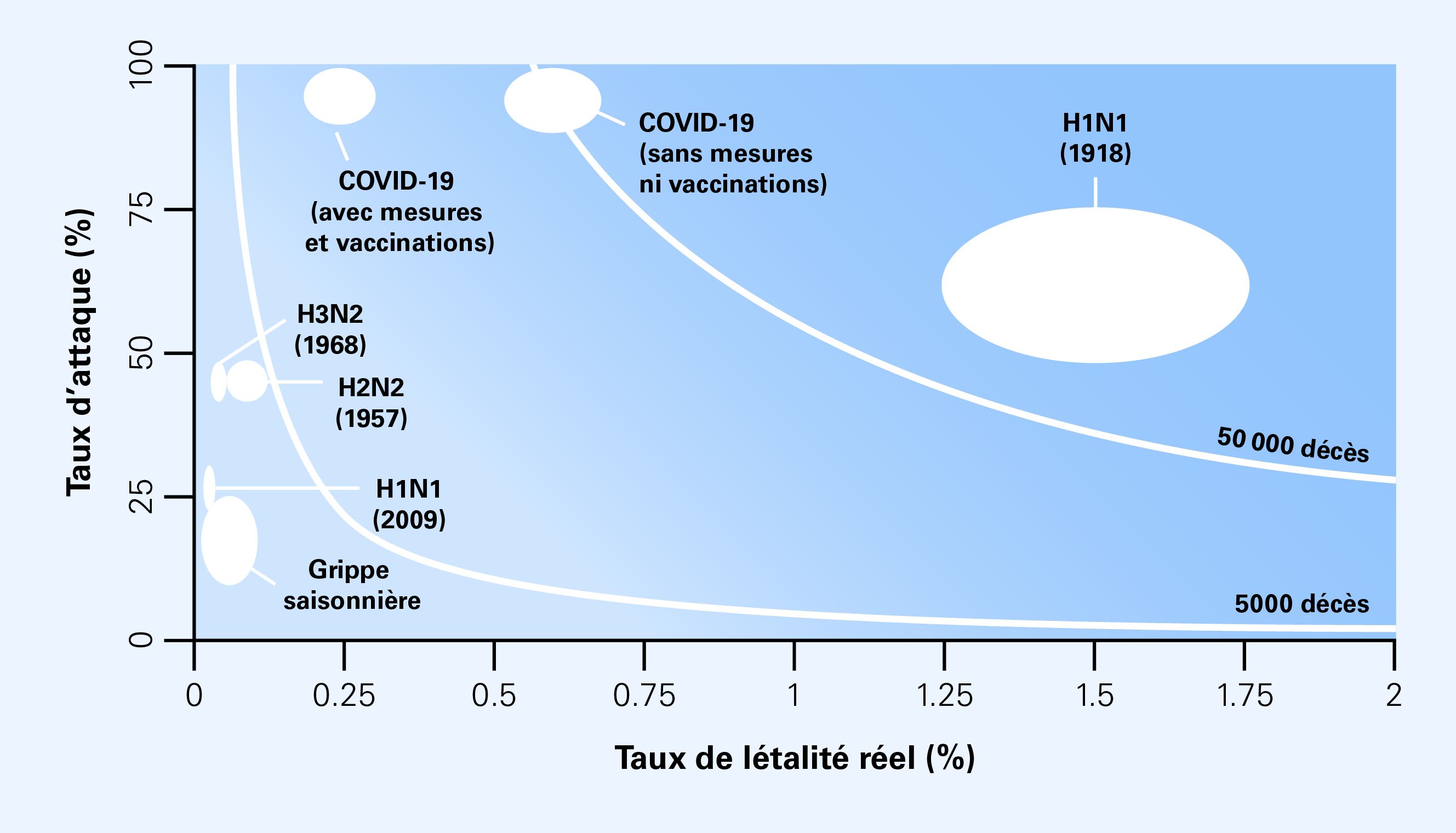
Le degré de gravité d’une pandémie peut être représenté à l’aide du nombre de décès résultant d’un taux d’attaque et d’un taux de létalité réel déterminés (figure 1). On peut ainsi comparer différents scénarios de pandémie avec les conséquences de pandémies passées ou de la grippe saisonnière. Les exemples historiques, qui vont d’événements modérés comme la pandémie de grippe H1N1 en 2009 jusqu’à des événements extrêmes comme la pandémie de grippe de 1918, illustrent l’ampleur du spectre des scénarios possibles. Rapporté à la taille de la population de la Suisse (9 millions de personnes à fin 2024), le degré de gravité d’une pandémie causée par un pathogène respiratoire d’origine virale peut se décliner grossièrement en trois scénarios.
La planification stratégique doit tenir compte également de la durée de la phase pandémique, du nombre de vagues d’infections ainsi que du nombre de personnes infectées à prendre en charge en même temps. En outre, le degré de gravité d’une pandémie ne doit pas être évalué uniquement sur la base du nombre de décès attendu, mais aussi en intégrant d’autres paramètres tels que le nombre de maladies graves dans différents groupes de population et catégories d’âge ou les possibles conséquences à long terme d’une infection.
Toutefois, tant l’évaluation des risques que l’élaboration de scénarios comportent des incertitudes. En effet, il n’est pas toujours possible d’obtenir en temps utile des informations détaillées sur la transmissibilité de l’agent pathogène ni sur le degré de gravité clinique des affections ou de caractériser ces paramètres avec une précision suffisante. L’évaluation des risques et l’élaboration de scénarios n’en restent pas moins des outils indispensables pour envisager les évolutions possibles et préparer des mesures appropriées. Il est crucial d’adapter régulièrement le fruit de ces travaux aux nouvelles connaissances scientifiques.

